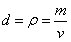Nasceu em Genebra, Suíça, em 7 de Agosto de 1802. Logo se mudou para a Rússia, onde cursou Medicina, Química e Geologia. Em 1830, tornou-se professor na Universidade de São Petersburgo. Fez inúmeros estudos sobre gás natural e minérios russos.
segunda-feira, 10 de agosto de 2009
BIOGRAFIA - Germain Henri HESS
Nasceu em Genebra, Suíça, em 7 de Agosto de 1802. Logo se mudou para a Rússia, onde cursou Medicina, Química e Geologia. Em 1830, tornou-se professor na Universidade de São Petersburgo. Fez inúmeros estudos sobre gás natural e minérios russos.
BIOGRAFIA - Antoine Laurent LAVOISIER
BIOGRAFIA - Amedeo AVOGADRO
quinta-feira, 6 de agosto de 2009
Química Geral - Modelo Atômico de Dalton
Entre 1803 e 1808, o cientista inglês John Dalton propôs uma teoria para explicar as Leis Ponderais (de Proust e Lavoisier). Esta teoria ficou conhecida como Teoria Atômica de Dalton ou, simplesmente, Modelo de Dalton.
1) Toda a matéria é formada por partículas extremamente pequenas, denominadas átomos;
2) os átomos são indivisíveis (esfera maciça e indivisível);
3) todos os átomos de um mesmo elemento são iguais, enquanto que os átomos de elementos diferentes também serão diferentes em tamanho, massa, etc.;
4) átomos de elementos diferentes se unem em proporções simples e constantes, formando os compostos químicos (as reações químicas são apenas recombinações de átomos).
OBS.: Dos postulados de Dalton, surgem dois conceitos:
a) as substâncias simples são formadas por um mesmo tipo de elemento;
b) as substâncias compostas são formadas por átomos de dois ou mais elementos químicos diferentes.
Química Geral - Leis Ponderais
O "método", isto é, o trabalho científico nas ciências experimetais - especialmente nas Química e na Física - desenvolveram-se, em linhas gerais, segundo o esquema:
SEQUÊNCIA DE PASSOS (Comentada)
1º) Observação de um fenômeno natural. Só interessa à Ciência a observação cuidadosa de um fenômeno que se repete (ou pode ser reproduzido) com frequência:
- largando um objeto, ele cai (fato indiscutível);
- hoje a noite aparecerá um disco voador (põe-se em dúvida).
2º) Para fzer a observação, deve-se esperar que o fenômeno aconteça. No entanto, pode-se provocar o fenômeno, desta forma está-se fazendo uma experiência.
- não é necessário que um objeto caia sozinho, pode-se deixá-lo cair de propósito.
OBS.: par uma experiência ser "científica", ela pode ser repetida quantas vezes quisermos; deve-se investigar, descobrir, medir, controlar e variar os fatores principais que possam influir na experiência (no estudo da queda de um corpo, deve-se pensar no tamanho, no peso, dimensões, ..., do corpo, na resistência do ar, na existência de vento, etc.). A experiência pode ser qualitativa (vamos ver "o que acontece"), quantitativa (vamos "medir" as grandezas).
3º) Reunindo as conclusões obtidas, numa quantidade significativa experiências, o cientista cria uma Lei Experimental ou Empírica.
Lei Experimental é uma afirmação de caráter geral, que traduz uma relação entre grandezas que intervêm no fenômeno.
Ex.: No vácuo, todos os corpos caem com igual aceleração.
OBS.: uma Lei Experimental só vale dentro dos limites e condições das experiências que foram feitas. Se houver alguma falha nas observações ou nas experiências que foram feitas, a Lei provavelmente estará errada.
4º) Depois de feitas as observações, planejam-se experiências e generalizam-se as conclusões numa Lei (ou Leis) Experimentais, a partir daqui criam-se explicações par os fatos - surge então a Hipótese.
Hipótese é uma primeira explicação (ou tentativa de explicação) dos fatos e que ainda não foi verificada, direta ou indiretamente.
5º) Se, com o passar dos anos a Hipótese continua explicando satisfatoriamente as novas observações feitas e as novas experiências imaginadas e se as "deduções" da hipótese se mostrarem úteis ao prosseguimento do "trabalho científico", então a hipótese vai "criando fama" e vai sendo aceita no "mundo científico". Agora, a união dessa hipótese com outras hipóteses "igualmente importantes", nos leva a um conjunto de ideias gerais denominado Teoria.
Teoria é uma explicação, de caráter geral, para uma série de fenômenos e que já foi "aprovada" num grande número de comprovações experimentais.
OBS.: a Teoria é a "coroação" do trabalho científico. Ela permite explicar muitos fenômenos, reduzindo-os a "ideias" ou "princípios gerais"; nos permite entender como as "coisas se passam", entender o "porque" das coisas, etc. Mas a curiosidade do homem não tem limites e, por isso, a Ciência nunca pára. Uma Teoria sempre "prevê" novos fenômenos, sugerindo novas observações, novas experiências, etc.
Ex.: a "hipótese da existência do átomo" feit por Dalton, está hoje em dia, tão "comprovada" (embora ninguém tenha visto um átomo) que não se fala mais em "hipótese" mas si em "Teoria Atômica de Dalton".
LEIS DAS REAÇÕES QUÍMICAS
São Leis Experimentais ou Empíricas, isto é, resultam de experiências ou comprovações feitas em laboratório. Estas Leis surgiram no final do século 18 e início do século 19. Tais antecederam e deram grande contribuição a uma grande mudança dentro da Química: o surgimento dos modelos atômicos. Estes conhecimentos unidos a tantos outros relatos culminaram na proposição de um modelo para o átomo.
As Leis das Reações Químicas se classificam em:
1) Leis Volumétricas: que dizem respeito aos volumes gasosos (são as Leis Volumétricas de Gay-Lussac).
2) Leis Ponderais: que dizem respeito às massas.
2.1) Lei da Conservação da massa (Lei de Lavoisier)
"A massa total de um sistema fechado não varia, qualquer que seja a reação química que aí se verifique".
OBS.: no começo do século XX, Albert Einstein ao criar sua Teoria da Relatividade, previu a possibilidade de se transformar matéria em energia e vice-versa. Através de um raciocínio matemático complicado, Einstein chegou a fórmula:
Esta fórmula comprometeu a Lei de Lavoisier. De fato, quando uma reação libera, por exemplo, calor, o aparecimento dessa energia deve estar correspondendo ao desaparecimento de uma certa quantidade de matéria. De forma inversa, quando um sistema absorve energia, a massa total do sistema deve aumentar.
Em resumo, a Lei de Lavoisier dizia: numa reação química a matéria (massa) se conserva e a Teoria de Einstein veio dizer: a matéria (massa) pode ser criada a partir de energia ou destruída dando origem a energia. E como foi resolvido esse impasse?
Devemos notar que numa reação química, as possíveis variações de massa, previstas pela Teoria de Einstein, são muito pequenas. De fato a reação de formação de água a partir dos gases hidrogênio e oxigênio, representada:
Nesta reação há liberação de 136.800 calorias. Utilizando a fórmula acima e fazendo a conversão da energia de calorias para ergs, obtemos o valor da variação da massa nesta reação que corresponde a 0,0000000062g. Como as balanças analíticas utilizadas normalmente tem precisão de 0,00001 g, a variação de massa não pode ser medida na balança, pois é muito pequena, assim esta variação pode ser desprezada, considerando então que a Lei de Lavoisier é praticamente correta.
OBS.2: A Teoria de Einstein tem uma importância muito grande nas reações nucleares. Na transformação de 4 átomos de hidrogênio em 1 átomo de hélio (como ocorre na bomba de hidrogênio) libera-se quantidade de energia suficiente para aquecer 5.900 toneladas de água de 0 a 100°.
2.2) Lei das Proporções Definidas (Constantes) ou Lei de Proust
Se tomarmos a massa de 9g de água, sua decomposição forma 1g de gás hidrogênio e 8g de gás oxigênio. A decomposição de 27g de água leva a formação de 3g de gás hidrogênio e 24g de gás oxigênio. Note que quando a massa de água passou de 9g para 27g (aumentou 3x), as massas dos gases também aumentaram na mesma proporção. Nota-se que, apesar das massas serem muito diferentes, a proporção entre as massas de hidrogênio e de oxigênio é sempre constante, fixa, definida ou invariável: 1:8; em outras palavras, na água, a massa do oxigênio é sempre oito vezes maior que a massa do oxigênio.
OBS.: Foi a descoberta de que cada composto tem seus elementos formadores, unidos numa proporção constante, que possibilitou aos cientistas a criação de uma fórmula química "constante" para cada composto químico, por isso, quando se fala em água, lembra-se de sua fórmula.
OBS.2: Consequência da Lei de Proust é a Composição Centesimal de um composto.
"Composição Centesimal de um composto são as porcentagens em massa dos elementos formadores do composto".
Ex.: a Composição Centesimal da água é 11,11% de Hidrogênio e 88,88% de Oxigênio.
2.3) Lei das Proporções Múltiplas ou Lei de Dalton
"As massas de um elemento químico, que se combinam com uma massa fixa de um segundo elemento, para formar compostos diferentes, estão sempre entre si numa proporção de números inteiros, em geral pequenos".
Ex.: Existem vários óxidos de nitrogênio e, no laboratório, constata-se que:
As massas variáveis estão na proporção de 1:2:3:4:5 (basta dividir todas pela menor massa).
2.4) Lei das Proporções Recíprocas ou Lei de Richter-Wenzel-Berzelius
"Considerando as massas de dois elementos químicos, que se combinam com uma massa fixa de um terceiro elemento, concluiremos que se os dois primeiros elementos reagirem entre si, eles o farão na mesma proporção das massas que haviam reagido com o terceiro elemento, ou então numa outra porporção formada por múltiplos ou submúltiplos dessas massas"
O enunciado da Lei é complicado, sem dúvida, vejamos de forma esquemática:
Ex.: Experimentalmente verifica-se que:
- 6g de carbono + 2g de hidrogênio formam Metano;
- 6g de carbono + 71g de cloro formam Tetracloreto de carbono
ao combinar 2g de hidrogênio com 71g de cloro forma-se Gás Clorídrico, assim, neste último composto, o hidrogênio e o cloro estão combinados entre si, ma mesma proporção (2:71) que haviam se combinado com a massa fixa (6g) de carbono.
OBS.: A principal consequência da Lei das Proporções Recíprocas é o conceito de equivalente-grama.
quarta-feira, 5 de agosto de 2009
Química Geral - Tipos de Mistura
 Fase: representa cada parte visualmente diferente do sistema. Utilizamos a visão para diferenciar uma mistura homogênea de uma mistura heterogênea.
Fase: representa cada parte visualmente diferente do sistema. Utilizamos a visão para diferenciar uma mistura homogênea de uma mistura heterogênea.
 Mistura Homogênea: apresenta aspecto contínuo, uniforme; ou seja, apresenta uma única fase.
Mistura Homogênea: apresenta aspecto contínuo, uniforme; ou seja, apresenta uma única fase.
Exemplo: água filtrada.
 Mistura Heterogênea: apresenta mais de uma fase, podemos ver claramente a diferença no sistema.
Mistura Heterogênea: apresenta mais de uma fase, podemos ver claramente a diferença no sistema.
Exemplo: água + areia.
OBS.: Considerando a mistura de areia, água e sal (dissolvido), podemos ver duas fases: areia e água + sal. Este sistema é classificado como heterogêneo. O que não podemos esquecer é que parte dele (água + sal) é formado por uma mistura homogênea.
 Componentes do sistema: o número de componentes do sistema representa o número de substâncias presentes no sistema. Assim, no sistema composto por areia, água e sal (dissolvido), temos duas fases (areia e água + sal) e três componentes (areia, água e sal). Num sistema formado por água filtrada e uma "pedra" de gelo, temos duas fases e um componente (o gelo é formado pela substância água).
Componentes do sistema: o número de componentes do sistema representa o número de substâncias presentes no sistema. Assim, no sistema composto por areia, água e sal (dissolvido), temos duas fases (areia e água + sal) e três componentes (areia, água e sal). Num sistema formado por água filtrada e uma "pedra" de gelo, temos duas fases e um componente (o gelo é formado pela substância água).
Química Geral - Fenômenos Físicos e Fenômenos Químicos
1) Fenômeno físico (Intermolecular): a composição da matéria se matém constante, ou seja, permanece a mesma antes e depois da ocorrência do fenômeno. A mudança ocorre entre as moléculas que formam a matéria,
Exemplos:
1) Gelo derretendo (temos "água sólida" no início e "água líquida" no final, assim temos a mesma matéia - a água - no início e no final da mudança. Adiferença básica entre o antes e o depois é a distância entre as moléculas e a energia, que ficammaiores ao se passar do estado sólido para o líquido).
2) Folha de papel sendo rasgada (está ocorrendo uma divisão da matéria, mas não deixa de ser papel só porque foi rasgado).
Exemplos:
1) Um papel sendo queimado (temos papel no início e cinzas no final).
Ao nos referirmos a um Fenômeno Físico usamos a palavra Mudança (na passagem do gelo para água líquida dizemos que houve uma Mudança de Estado Físico). Ao nos referirmos a um Fenômeno Químico usamos a palavra Transformação. Quado queimamos gasolina ocorre uma Transformação da gasolina.
Observando as mudanças / transformações materiais, com mais cuidado podemos perceber que:
a) algumas são "passageiras", isto é, podem ser feitas e desfeitas com mais facilidade (Reversíveis);
Ex.: resfriando-se água forma-se gelo e aquecendo-se gelo forma-se água.
b) algumas são "permanentes", isto é, são impossíveis de serem desfeitas (Irreversíveis).
Ex.: depois que a madeira é queimada não há como das cinzas e fumaça fazer madeira.
OBSERVAÇÃO: um conceito muitas vezes ensinado errado é de que Fenômenos Físicos são reversíveis e Fenômenos Químicos são irreversíveis.
Podemos ter Fenômenos Físicos reversíveis (água solidificando e gelo derretendo) e irreversíveis (ao quebrar um lápis ele não deixa de ser lápis, mas não pode voltar a ser como era simplesmente juntando-se as partes).
Podemos ter Fenômenos Químicos reversíveis (reação entre gás hidrogênio e gás oxigênio formando água e decomposição da água em gás oxigênio e gás hidrogênio) e irreversíveis (depois riscar um fósforo não conseguimos repetir da mesma forma a produção de fogo).
Química Geral - Gráficos de Mudanças de Estados Físicos
 |
| Gráfico de mudança de estado físico ao aquecer uma substância. |
 |
| Gráfico de mudança de estado físico ao aquecer uma mistura comum. |
 |
| Gráfico de mudança de estado físico ao aquecer uma mistura eutética. |
 |
| Gráfico de mudança de estado físico ao aquecer uma mistura azeotrópica. |
1ª) Uma amostra para ser considerada substância deve possui PF e PE constantes;
2ª) A simples afirmação de que uma amostra possui PE ou PF constantes não serve para concluir que se trata de uma substância, pois a mistura eutética possui PF constante e a mistura azeotrópica possui PE constante;
3ª) A afirmação de que a amostra possui PE ou PF variável já é suficiente para classificar a amostra como mistura;
4ª) Para concluirmos se a amostra se trata de uma mistura comum, mistura eutética ou mistura azeotrópica; devemos ter informações sobre as temperaturas de fusão e ebulição.
5ª) A mistura azeotrópica citada acima (96% álcool e 4% água) não pode ser separada por destilação, pois ambas as substâncias ebulem na mesma temperatura, nesta proporção que se encontram, é por isso que nas destilarias de álcool destila-se o álcool até a concentração de 96% - chamado de álcool hidratado. Para a obtenção de álcool anidro (sem água) são utilizados outros métodos para separar a água.
Química Geral - Mudanças de Estados Físicos
1ª) Evaporação: passagem lenta do estado líquido para o estado gasoso (quando temos uma roupa molhada secando ao Sol);
2ª) Ebulição: passagem do estado líquido para o estado gasoso com formação de bolhas (quando fervemos água para fazer café);
3ª) Calefação: passagem brusca (muito rápida) do estado líquido para o estado gasoso (quando colocamos um hamburger congelado numa frigideira quente, o gelo passa bruscamente do sólido para o líquido e do líquido para o gasoso).
Observação 2: Quando há passagem de um Estado Físico de menor energia para um estado de maior energia é necessário fornecer energia ao sistema (setas vermelhas), quando se passa de um estado de maior energia para um estado de menor energia é necessário retirar energia do sistema (setas azuis).
Química Geral - Estados Físicos da Matéria

No que se diferenciam os estados sólido, líquido e gasos?
1) Externamente:
Sólido: tem forma constante e volume constante;
Líquido: tem forma variável (tendo a forma do recipiente que o contém) e volume constante;
Gasoso: tem forma variável (tendo a forma do recipiente que o contém) e volume variável (sempre ocupa todo volume disponível).
2) Internamente:
Substâncias Sólidas: em condições ambientais, são formadas por partículas que podem ser átomos, moléculas ou íons, as quais:
a) Permanecem muito próximas entre si, pois entre elas há fortes forças de atração (coesão);
b) As partículas não "saem do lugar", apenas vibram na posição onde se encontram;
c) as partículas esta bem arrumadas, seguindo uma ordem geométrica bem definida.
OBS.: a arrumação geométrica seguida pelas partículas é chamada de grade, rede ou retículo cristalino e as posições ocupadas pelas partículas denominam-se nós do reticulado.
Ex.: o sal de cozinha (cloreto de sódio - NaCl) é um sólido formado pela aglomeração de íons positivos de sódio (Na) e íons negativos de cloro (Cl). Como esses íons possuem cargas elétricas de sinais contrários, eles se atraem fortemente e permanecem aglomerados, sem possibilidade de se moverem, da seguinte maneira:
OBS.: alguns sólidos não possuem suas partículas de forma organizada, sendo estes chamados de sólidos amorfos. O vidro é exemplo de um sólido amorfo, por não apresentar organização das partículas como é comum nos sólidos. O sólido amorfo é considerado como um estado intermediário entre líquido e sólido. O vidro possui muitas características dos sólidos (forma definida, dureza, etc.), mas não possuem forma cristalina definida, pois suas partículas está dispersas desordenadamente como nos líquidos. O vidro comum é preparado em altas temperaturas (1300 a 1600°C), quando é totalmente fluído. Deopis é resfriado lentamente e vai se tornando cada vez mais viscoso até "solidificar"; daí dizer que o vidro é um "líquido super-resfriado" ou que esta no "estado vítreo". Interessante ressaltar que mesmo depois de ter "solidificado" suas partículas procuram "mexer" e se "arrumar" da melhor maneira que elas podem, é por isso que muitas vezes um objeto de vidro (copo, vaso, etc.) "trinca" espontaneamente.
Substâncias líquidas: em condições ambinetes são formados geralmente por moléculas as quais:
a) Permanecem um pouco mais afastadas entre si do que as partículas formadoras dos sólicos. Por isso a maior parte das substâncias sofre um pequeno aumento de volume ao fundir (excessão a essa regra são água, ferro, prata e bismuto).
b) As partículas estão "unidas" por forças de atração mais fracas do que as existentes no sólidos. Por isso um barco pode "cortar" a superfície da água com facilidade.
OBS.: na superfície do líquido as foças de atração é mais acentuada, criando uma Tensão Superficial, que procura impedir a penetração de outro material. Por isso, certos insetos conseguem andar sobre a água.
c) As partículas um um líquido têm liberdade de se movimentarem, de forma desordenada, dentro do líquido. As vezes, uma ou outra partícula consegue vencer a barreira da Tensão Superficial, por isso o líquido vai lentamente evaporando.
OBS.: Esta liberdade de movimentação das partículas do líquido permite que ele flua de um recipiente para outro e que um líquido se misture com outro.
Substâncias Gasosas: em condições ambientais são formadas por átomos (gases nobres) ou moléculas, de tal modo que:
a) As partículas permanecem muito mais afastadas em si do que as partículas de sólidos e líquidos. Assim podemos concluir que no estado gasoso as partículas estão tão afastadas entre si que o "espaço vazio" é muitíssimo maior do que o espaço preenchido pelas partículas do gás, por isso os gases são muito compressíveis.
b) As forças de coesão que "unem" as partículas gasosas são muitíissimo mais fracas que as existentes entre as partículas de sólidos e líquidos. Assim, podemos "abrir caminho" entre as partículas do ar ao andar quase sem preceber que estamos fazendo, poré, quando a velocidade é alta, é necessária melhorar a aerodinâmica para melhor atravessar o ar.
c) As partículas de um gás estão sempre em movimento muito rápido e totalmente desordenado, em todas as direções e sentidos. É devido ao movimento rápido e em todas as direções das partículas que constituem o gás que, um gás procura sempre expandir, ocupando todo o volume disponível.
Química Geral - Substâncias e Misturas
Exemplo: liga contendo 40% de cádmio e 60% de bismuto;
Exemplo: mistura de 96% de álcool e 4% de água.
Visualmente, podemos classificar as misturas em Homogêneas ou Heterogêneas:
1) Misturas Homogêneas: possuem 1 fase, visualmente, todas as partes da misturas são iguais.
Ex.: água com sal dissolvido (depois de dissolvido, só conseguimos ver a água).
2) Misturas Heterogêneas: possuem mais de 1 fase, visualmente, podemos ver partes diferentes da mistura.
Ex.: mistura de brita e areia (podemos ver a brita e a areia mesmo quando estão misturados).
Fase: corresponde a cada parte visualmente diferente da mistura.
Componentes: corresponde a cada substância diferente presente na mistura.
Ex.: a mistura de gelo e água possui 2 fases (água e gelo) e 1 componente (água líquida e água sólida, mas somente água).
Observação: O termo "substância pura" é utilizado de maneira errada, já que o conceito de substância já indica que é pura, ou seja, uma "substância impura" é aquela que possui outra coisa além da substância - a impureza - sendo o conjunto chamado de mistura. Ao dizer "substância pura" você comete o mesmo erro quando diz "subir para cima", "sair para fora". Os professores de língua portuguesa chamam isso de Pleonasmo.
Química Geral - Propriedades da Matéria
Existem vários tipos de propriedades que caracterizam a matéria, entre elas, as principais são:
1. Propriedades físicas: São aquelas que podem ser medidas e observadas sem alterar a composição química da substância. Por exemplo, quando medimos a temperatura da água com um termômetro, ela não sofre nenhuma alteração, continua sendo água, então, a temperatura é uma propriedade física da matéria.
A cada propriedade física corresponde uma medida que é constante para a substância e, por isso, é chamada de constante física da substância.
As principais constantes físicas são:
a) Ponto de Fusão (PF) ou Temperatura de Fusão (TF): é a temperatura na qual a substância passa do estado sólido para o líquido, sob determinada pressão.
b) Ponto de Solidificação ou Ponto de Congelamento: é a temperatura na qual a substância passa do estado líquido para o estado sólido.
OBS.: para as substâncias, os Pontos de Fusão e Pontos de Solidificação coincidem.
c) Ponto de Ebulição (PE) ou Temperatura de Ebulição (TE): é a temperatura na qual a substância passa do estado líquido para o gasoso.
d) Ponto de Liquefação/Condensação ou Temperatura de Liquefação/Condensação: é a temperatura na qual a substância passa do estado gasoso para o líquido.
OBS.: para as substâncias, os Pontos de Ebulição e Pontos de Liquefação/Condensação coincidem.
e) Densidade ou Massa Específica: é a relação / proporção (divisão) entre a massa e o volume. Utilizamos, normalmente a letra "d" para representar a densidade numa fórmula. A densidade era chamada de massa específica, mas esta expressão não é mais utilizada. A grande vantagem do uso da densidade está no seu caráter específico: a densidade não depende de quanta matéria é composta uma amostra. Por exemplo, a densidade da água, a 25°C, é 1g/1mL; não interessa se temos um litro de água ou uma tonelada de água, quando fazemos a divisão entre a massa e volume da amostra, obtemos o valor 1g/mL. A densidade também pode ser representada pela letra grega "rô", como mostrado na figura a seguir:
f) Solubilidade: é a capacidade de uma substância (soluto) se dissolver em outra (solvente). A solubilidade é medida pelo chamado Grau de Solubilidade ou Coeficiente de Solubilidade que representa a quantidade máxima de substância que pode ser dissolvida, de maneira estável, numa quantidade fixa de solvente em determinada temperatura e pressão.
Ex.: a solubilidade do sal de cozinha em água é 357g/L a 0°C, isto significa que 1 litro de água a 0°C pode dissolver no máximo 357g de sal de cozinha.
OBS.: Também são constantes físicas: calor específica, índice de refração, tensão superficial, viscosidade, etc.
As propriedades físicas podem ser subdivididas em gerais ou específicas, organolépticas e intensivas ou extensivas.
1.1. Propriedades gerais: São aquelas comuns a toda matéria. Por exemplo, se medirmos o volume de um material e descobrirmos que ele é igual a 10 mL, não conseguimos saber que material é este pois, toda matéria tem volume e pode ter volume de 10 mL. A massa, a temperatura e o estado físico (sólido, líquido e gasoso) também são exemplos de propriedades gerais. Também são propriedades gerais Impenetrabilidade (dois corpos não podem ocupar o mesmo espaço ao mesmo tempo); Divisibilidade (a matéria pode ser dividida inúmeras vezes sem alterar suas características - desde que não ocorra fenômeno químico); Compressibilidade (o volume ocupado pela matéria pode diminuir, se ela for submetida à ação de forças externas - mais perceptível com gases); Elasticidade (se um material no estado sólido for esticado ou comprimido pela ação de forças externas sem que sua estrutura seja rompida, ele voltará a sua forma original assim que essa força deixar de agir); Inércia (os corpos tendem a manter seus estados de repouso ou de movimento até que uma força externa modifique sua situação inicial).
OBS.: evidentemente, as propriedades gerais não servem para distinguir uma substância de outra.
1.2. Propriedades específicas: são específicas para cada matéria, que podem ser usadas para identificar a matéria que está sendo analisada. Essas propriedades são apresentadas exclusivamente por um material quando puro. Exemplos: densidade, pontos de fusão e ebulição e coeficiente de solubilidade.
Se tivermos um líquido incolor e quisermos identificá-lo podemos medir as propriedades específicas desse líquido. Se descobrirmos que a sua densidade a 25º C e 1 atm é igual a 1,0 g/mL, seu ponto de fusão é 0ºC ao nível no mar e que seu ponto de ebulição é de 100ºC também ao nível do mar, então, não haverá dúvidas que trata-se da água, pois essas propriedades pertencem somente a ela e a mais nenhuma outra substância.
São exemplos de propriedades organolépticas:
a) estado físico ou estado de agregação - sólido, líquido ou gasoso.
b) dureza - uma substância é mais dura que a outra quando é capaz de riscar essa outra substâsncia.
c) cor - há substâncias incolores (como água) e substâncias coloridas (enxofre é amarelo, o sulfato de cobre hidratado é azul).
d) brilho - certos materiais não tem brilho (como enxofre, gesso), os metais apresentam um brilho característico chamado Brilho Metálico; o vidro e o quartzo apresentam Brilho Vítreo, etc.
e) odor - há substâncias sem cheiro (inodoras) como a água; outras tem os mais variados cheiros (sentimos o cheiro do cloro em piscinas, o gás sulfídrico tem cheiro de ovo podre, etc.).
f) sabor - há substâncias sem sabor (insípidas) como a água, e outras dos mais variados sabores: áçúcar (doce), sal (salgado), vinagre (azedo), etc.
OBS.: o uso de propriedades organolépticas no reconhecimento de substâncias é restrito pois, nossos sentidos falham muitas vezes neste processo e muitas substâncias são perigosas para serem cheiradas ou provadas e mesmo tocadas.
1.4. Propriedades intensivas: São aquelas que não dependem da massa da amostra, isto é, ela é constante em qualquer parte da matéria. Por exemplo, a densidade de um cubo de gelo é a mesma de um iceberg (0,92 g/mL). A temperatura também é uma propriedade intensiva.
1.5. Propriedades extensivas: São aquelas que dependem do tamanho da amostra. O volume é uma propriedade extensiva. Por exemplo, 5 kg de água não ocupam o mesmo volume (espaço) que 1 kg.
Por exemplo, a combustão (queima) é uma propriedade que o álcool etílico possui. Quando ele queima, sua composição química muda, transformando-se em novas substâncias. Outros exemplos de propriedades químicas são: oxidação, redução e reatividade.
Entre as propriedades químicas, temos algumas que são classificadas como propriedades de grupo (ou propriedades funcionais):
2.1. Propriedades de grupo: Algumas substâncias possuem propriedades químicas em comum e, por isso, são classificadas em grupos específicos, que são chamados de grupos funcionais ou de funções.
Por exemplo, uma função inorgânica é a dos ácidos. Todos esses compostos liberam em meio aquoso como único cátion o H+ e possuem as seguintes propriedades:
* Conduzem corrente elétrica em meio aquoso;
* Reagem com metais, produzindo gás hidrogênio;
Outras funções inorgânicas são: bases, sais, óxidos, anidridos, peróxidos, superóxidos. Já as funções orgânicas incluem: hidrocarbonetos, álcoois, aldeídos, cetonas, ácidos carboxílicos, ésteres, éteres, aminas, amidas, nitrilas, isonitrilas, isocianatos, anidridos, entre outras.
Química Geral - Estudo da Matéria
 Definição
DefiniçãoA definição clássica de matéria enuncia: "Matéria é tudo que tem massa e ocupa lugar no espaço".
De modo que, tudo que podemos pesar, medir volume; no universo ao nosso redor, é matéria. Ex.: pedras, madeira, água, ar.
Há "coisas", porém, que não são matérias: o som, a luz, o calor, etc.
 Massa
MassaÉ a medida da quantidade da matéria. Quando subimos em uma balança estamos medindo nossa massa, quanta matéria temos no nosso corpo. As unidades de medidas de massa mais comuns são: o grama (g), o quilograma (Kg). A medida de massa depende de quanta matéria estamos manipulando, quanto mais matéria, maior sua massa. Utilizamos a letra "m" para nos referirmos à massa numa fórmula.
 Volume
VolumeÉ a medida do espaço ocupado pela matéria. As unidades de medida de massa mais utilizadas são: o Litro (L), o mililitro (mL), o centímetro cúbico (cm3), o metro cúbico (m3). O volume depende de quanta matéria estamos lidando. Quanto mais matéria estivermos analisando, maior será o seu volume. Utilizamos a letra "v" para nos referirmos ao volume numa fórmula.
 Corpo
CorpoÉ qualquer porção limitada de matéria. Ex.: madeira é matéria, porém, um pedaço de madeira é um corpo.
 Sistema
SistemaÉ qualquer porção limitada do espaço contendo ou não matéria, e que seja objeto de nosso estudo.
 Meio ambiente
Meio ambienteÉ o restante do universo, excluindo-se o sistema em estudo.
Exemplo: uma lata de panetone (mesmo que vazia) é um sistema material (quando estamos interessados na lata); tudo o que está fora da lata é o Meio Ambiente.
Como funciona a Química?

1) Nível Macroscópico (ou dos Fenômenos): nível em que são feitas as observações.
Ex.: ao retirar um cubo de gelo do congelador colocando-o num prato, observa-se que o gelo vai "derretendo" com o passar do tempo, até que se torne totalmente líquido.
2) Nível Microscópico (ou Atômico): este nível é invisível aos nossos olhos. Aqui o fenômeno macroscópico observado é explicado em termos de reorganização dos átomos, moléculas, etc.
Ex.: a medida que o tempo passa, as moléculas de água que estão no estado sólido (gelo) vão absorvendo energia e vão cada vez mais se afastando, passando para o estado líquido.
3) Nível Representacional (ou Simbólico): neste nível representa-se o que acontece microscopicamente (em termos de átomos, moléculas, etc) o fenômeno macroscópico (observado), utilizando uma linguagem própria da Química: símbolos, fórmulas, equações.
Ex.:
Deixo aqui em formato PDF um artigo mais detalhado sobre O QUE É E COMO FUNCIONA A QUÍMICA.