Existem vários tipos de propriedades que caracterizam a matéria, entre elas, as principais são:
1. Propriedades físicas: São aquelas que podem ser medidas e observadas sem alterar a composição química da substância. Por exemplo, quando medimos a temperatura da água com um termômetro, ela não sofre nenhuma alteração, continua sendo água, então, a temperatura é uma propriedade física da matéria.
A cada propriedade física corresponde uma medida que é constante para a substância e, por isso, é chamada de constante física da substância.
As principais constantes físicas são:
a) Ponto de Fusão (PF) ou Temperatura de Fusão (TF): é a temperatura na qual a substância passa do estado sólido para o líquido, sob determinada pressão.
b) Ponto de Solidificação ou Ponto de Congelamento: é a temperatura na qual a substância passa do estado líquido para o estado sólido.
OBS.: para as substâncias, os Pontos de Fusão e Pontos de Solidificação coincidem.
c) Ponto de Ebulição (PE) ou Temperatura de Ebulição (TE): é a temperatura na qual a substância passa do estado líquido para o gasoso.
d) Ponto de Liquefação/Condensação ou Temperatura de Liquefação/Condensação: é a temperatura na qual a substância passa do estado gasoso para o líquido.
OBS.: para as substâncias, os Pontos de Ebulição e Pontos de Liquefação/Condensação coincidem.
e) Densidade ou Massa Específica: é a relação / proporção (divisão) entre a massa e o volume. Utilizamos, normalmente a letra "d" para representar a densidade numa fórmula. A densidade era chamada de massa específica, mas esta expressão não é mais utilizada. A grande vantagem do uso da densidade está no seu caráter específico: a densidade não depende de quanta matéria é composta uma amostra. Por exemplo, a densidade da água, a 25°C, é 1g/1mL; não interessa se temos um litro de água ou uma tonelada de água, quando fazemos a divisão entre a massa e volume da amostra, obtemos o valor 1g/mL. A densidade também pode ser representada pela letra grega "rô", como mostrado na figura a seguir:
OBS.: é comum ser dada a densidade de uma substância em relação a outra, chamada de Densidade Relativa. A densidade de sólidos e líquidos é dada em relação a água, indicando quantas vezes o sólido ou líquido é mais ou menos denso que a água. A densidade relativa dos gases é normalmente dada em relação a densidade do ar, mas pode ser também dada em função da densidade do gás hidrogênio.
f) Solubilidade: é a capacidade de uma substância (soluto) se dissolver em outra (solvente). A solubilidade é medida pelo chamado Grau de Solubilidade ou Coeficiente de Solubilidade que representa a quantidade máxima de substância que pode ser dissolvida, de maneira estável, numa quantidade fixa de solvente em determinada temperatura e pressão.
Ex.: a solubilidade do sal de cozinha em água é 357g/L a 0°C, isto significa que 1 litro de água a 0°C pode dissolver no máximo 357g de sal de cozinha.
OBS.: Também são constantes físicas: calor específica, índice de refração, tensão superficial, viscosidade, etc.
As propriedades físicas podem ser subdivididas em gerais ou específicas, organolépticas e intensivas ou extensivas.
f) Solubilidade: é a capacidade de uma substância (soluto) se dissolver em outra (solvente). A solubilidade é medida pelo chamado Grau de Solubilidade ou Coeficiente de Solubilidade que representa a quantidade máxima de substância que pode ser dissolvida, de maneira estável, numa quantidade fixa de solvente em determinada temperatura e pressão.
Ex.: a solubilidade do sal de cozinha em água é 357g/L a 0°C, isto significa que 1 litro de água a 0°C pode dissolver no máximo 357g de sal de cozinha.
OBS.: Também são constantes físicas: calor específica, índice de refração, tensão superficial, viscosidade, etc.
As propriedades físicas podem ser subdivididas em gerais ou específicas, organolépticas e intensivas ou extensivas.
1.1. Propriedades gerais: São aquelas comuns a toda matéria. Por exemplo, se medirmos o volume de um material e descobrirmos que ele é igual a 10 mL, não conseguimos saber que material é este pois, toda matéria tem volume e pode ter volume de 10 mL. A massa, a temperatura e o estado físico (sólido, líquido e gasoso) também são exemplos de propriedades gerais. Também são propriedades gerais Impenetrabilidade (dois corpos não podem ocupar o mesmo espaço ao mesmo tempo); Divisibilidade (a matéria pode ser dividida inúmeras vezes sem alterar suas características - desde que não ocorra fenômeno químico); Compressibilidade (o volume ocupado pela matéria pode diminuir, se ela for submetida à ação de forças externas - mais perceptível com gases); Elasticidade (se um material no estado sólido for esticado ou comprimido pela ação de forças externas sem que sua estrutura seja rompida, ele voltará a sua forma original assim que essa força deixar de agir); Inércia (os corpos tendem a manter seus estados de repouso ou de movimento até que uma força externa modifique sua situação inicial).
OBS.: evidentemente, as propriedades gerais não servem para distinguir uma substância de outra.
1.2. Propriedades específicas: são específicas para cada matéria, que podem ser usadas para identificar a matéria que está sendo analisada. Essas propriedades são apresentadas exclusivamente por um material quando puro. Exemplos: densidade, pontos de fusão e ebulição e coeficiente de solubilidade.
Se tivermos um líquido incolor e quisermos identificá-lo podemos medir as propriedades específicas desse líquido. Se descobrirmos que a sua densidade a 25º C e 1 atm é igual a 1,0 g/mL, seu ponto de fusão é 0ºC ao nível no mar e que seu ponto de ebulição é de 100ºC também ao nível do mar, então, não haverá dúvidas que trata-se da água, pois essas propriedades pertencem somente a ela e a mais nenhuma outra substância.
1.3. Propriedades organolépticas: São aquelas que podem ser analisadas com os nossos sentidos, tais como visão, olfato, tato e paladar . Algumas dessas propriedades são: cor, cheiro, sabor, brilho e dureza. Por exemplo, o ferro é um metal duro.
São exemplos de propriedades organolépticas:
a) estado físico ou estado de agregação - sólido, líquido ou gasoso.
b) dureza - uma substância é mais dura que a outra quando é capaz de riscar essa outra substâsncia.
c) cor - há substâncias incolores (como água) e substâncias coloridas (enxofre é amarelo, o sulfato de cobre hidratado é azul).
d) brilho - certos materiais não tem brilho (como enxofre, gesso), os metais apresentam um brilho característico chamado Brilho Metálico; o vidro e o quartzo apresentam Brilho Vítreo, etc.
e) odor - há substâncias sem cheiro (inodoras) como a água; outras tem os mais variados cheiros (sentimos o cheiro do cloro em piscinas, o gás sulfídrico tem cheiro de ovo podre, etc.).
f) sabor - há substâncias sem sabor (insípidas) como a água, e outras dos mais variados sabores: áçúcar (doce), sal (salgado), vinagre (azedo), etc.
OBS.: o uso de propriedades organolépticas no reconhecimento de substâncias é restrito pois, nossos sentidos falham muitas vezes neste processo e muitas substâncias são perigosas para serem cheiradas ou provadas e mesmo tocadas.
1.4. Propriedades intensivas: São aquelas que não dependem da massa da amostra, isto é, ela é constante em qualquer parte da matéria. Por exemplo, a densidade de um cubo de gelo é a mesma de um iceberg (0,92 g/mL). A temperatura também é uma propriedade intensiva.
1.5. Propriedades extensivas: São aquelas que dependem do tamanho da amostra. O volume é uma propriedade extensiva. Por exemplo, 5 kg de água não ocupam o mesmo volume (espaço) que 1 kg.
2. Propriedades químicas: referem-se à capacidade de uma substância de sofrer transformações.
Por exemplo, a combustão (queima) é uma propriedade que o álcool etílico possui. Quando ele queima, sua composição química muda, transformando-se em novas substâncias. Outros exemplos de propriedades químicas são: oxidação, redução e reatividade.
Entre as propriedades químicas, temos algumas que são classificadas como propriedades de grupo (ou propriedades funcionais):
2.1. Propriedades de grupo: Algumas substâncias possuem propriedades químicas em comum e, por isso, são classificadas em grupos específicos, que são chamados de grupos funcionais ou de funções.
Por exemplo, uma função inorgânica é a dos ácidos. Todos esses compostos liberam em meio aquoso como único cátion o H+ e possuem as seguintes propriedades:
* Conduzem corrente elétrica em meio aquoso;
* Reagem com metais, produzindo gás hidrogênio;
Outras funções inorgânicas são: bases, sais, óxidos, anidridos, peróxidos, superóxidos. Já as funções orgânicas incluem: hidrocarbonetos, álcoois, aldeídos, cetonas, ácidos carboxílicos, ésteres, éteres, aminas, amidas, nitrilas, isonitrilas, isocianatos, anidridos, entre outras.
Por exemplo, a combustão (queima) é uma propriedade que o álcool etílico possui. Quando ele queima, sua composição química muda, transformando-se em novas substâncias. Outros exemplos de propriedades químicas são: oxidação, redução e reatividade.
Entre as propriedades químicas, temos algumas que são classificadas como propriedades de grupo (ou propriedades funcionais):
2.1. Propriedades de grupo: Algumas substâncias possuem propriedades químicas em comum e, por isso, são classificadas em grupos específicos, que são chamados de grupos funcionais ou de funções.
Por exemplo, uma função inorgânica é a dos ácidos. Todos esses compostos liberam em meio aquoso como único cátion o H+ e possuem as seguintes propriedades:
* Conduzem corrente elétrica em meio aquoso;
* Reagem com metais, produzindo gás hidrogênio;
Outras funções inorgânicas são: bases, sais, óxidos, anidridos, peróxidos, superóxidos. Já as funções orgânicas incluem: hidrocarbonetos, álcoois, aldeídos, cetonas, ácidos carboxílicos, ésteres, éteres, aminas, amidas, nitrilas, isonitrilas, isocianatos, anidridos, entre outras.

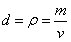
Nenhum comentário:
Postar um comentário